Was Sie über Batterien wissen sollten

In unserer sich schnell entwickelnden Welt sind Batterien zu einem festen Bestandteil des täglichen Lebens geworden und haben die Art und Weise, wie wir Energie nutzen und speichern, revolutioniert. Von der Stromversorgung unserer Smartphones über den Antrieb von Elektrofahrzeugen bis hin zur Speicherung erneuerbarer Energien – Batterien haben seit ihrer Erfindung einen langen Weg zurückgelegt. In diesem Blogbeitrag tauchen wir in die umfangreiche Welt der Batterien ein und erforschen ihre Geschichte, ihre grundlegende Funktionsweise und ihre unterschiedlichen Typen.
Wann wurde die Batterie erfunden? – Ein geschichtlicher Überblick
Die Geschichte der Batterien lässt sich bis ins späte 18. Jahrhundert zurückverfolgen, als der italienische Physiker Alessandro Volta die „Volta’sche Säule“ erfand, die erste elektrochemische Batterie. Er verwendete Kupfer- und Zinkplatten, die durch in Salzlake getränkte Papierscheiben getrennt waren, um einen gleichmäßigen Strom zu erzeugen. Volta missverstand jedoch die Spannungsquelle, und erst durch die Arbeit von Michael Faraday im Jahr 1834 wurde die wahre Natur der Zellen verstanden.
Im Laufe der Jahre hat sich die Batterietechnologie erheblich weiterentwickelt, wobei Wissenschaftler und Ingenieure ständig auf neue Grenzen stießen, um Effizienz und Leistung zu verbessern. So waren die ersten Batterien zwar für Experimente nützlich, verfügten aber nicht über stabile Spannungen und eine dauerhafte Leistungsabgabe. Erst mit der Erfindung des Daniell-Elements im Jahre 1836 wurden die ersten Batterien in der Industrie eingesetzt – hauptsächlich zur Versorgung von Telegrafennetzen. Diese waren jedoch aufgrund ihrer flüssigen Elektrolyte und Glasgefäße anfällig für Leckagen und Brüche, was sie für tragbare Anwendungen ungeeignet machte. Als Lösung wurde Ende des 19. Jahrhunderts die Trockenbatterie eingeführt, die sich für tragbare elektrische Geräte eignete.
Sowohl Nass- als auch Trockenbatterien werden heute noch verwendet, wenn auch oft in abgewandelter Form. Gängige Beispiele für Trockenbatterien sind Alkali- oder Lithium-Ionen-Batterien, die typischerweise in tragbaren Geräten verwendet werden. Ein praktisches Beispiel für eine Nassbatterie ist die Blei-Säure-Gel-Batterie, die immer noch häufig als Autobatterie oder für die Notstromversorgung von Gebäuden verwendet wird.
Wie funktionieren Batterien? – Das grundlegende Funktionsprinzip
Vereinfacht gesagt, wandeln Batterien chemische Energie in elektrische Energie um, und zwar durch eine elektrochemische Reaktion von Metallen, Oxiden oder Molekülen. Wir werden diese Reaktion anhand des Funktionsprinzips einer galvanischen (oder voltaischen) Zelle beschreiben, da eine klassische Batterie aus mehreren galvanischen Zellen besteht.
Hinweis: Galvanische Zellen werden auch voltaische Zellen genannt und basieren auf demselben Funktionsprinzip. Beide Begriffe werden verwendet, da sowohl Luigi Galvani als auch Alessandro Volta eine wesentliche Rolle bei der Erfindung der ersten Batterie spielten.
In ihrer einfachsten Form besteht eine einzelne galvanische Zelle aus zwei Halbzellen, die durch eine semipermeable Membran oder eine Salzbrücke verbunden sind. Jede Halbzelle besteht aus einem Metall (Elektrode), das in eine Lösung mit den zugehörigen Metallionen (Elektrolyten) getaucht ist. Eine der beiden Halbzellen enthält eine negative Elektrode (Anode), die Anionen (negativ geladene Ionen) anzieht, während die andere Halbzelle eine positive Elektrode (Kathode) enthält, die Kationen (positiv geladene Ionen) anzieht.
Abbildung 1 zeigt eine schematische Darstellung basierend auf einer Zink-Kupfer-Zelle (Zn-Cu). Die blaue Halbzelle zeigt die Zn-Elektrode (Anode), die sich in einer Lösung von ZnSO4 (Zinksulfat) befindet. Die grüne Halbzelle enthält die Cu-Elektrode (Kathode) in einer Lösung von CuSO4 (Kupfersulfat). Eine Salzbrücke verbindet die Sulfate. Schließt man nun den Stromkreis über einen externen elektrischen Leiter, lösen sich Zn2+-Ionen von der Zn-Elektrode in die Lösung (Oxidation) und Elektronen treten in den externen Leiter ein. Um die erhöhte Zinkionenkonzentration auszugleichen, verlassen Zinkionen die Zinkhalbzelle und Anionen treten über die Salzbrücke ein. In der Kupferhalbzelle lagern sich die Cu2+-Ionen (Kationen) an der Cu-Elektrode an (Reduktion) und nehmen Elektronen aus dem externen Leiter auf.
Diese chemische Reaktion kann durch die folgende Reduktions-Oxidations-Gleichung (Redox) beschrieben werden:
Zn(s) + Cu2+(aq) –> Zn2+(aq) + Cu(s)
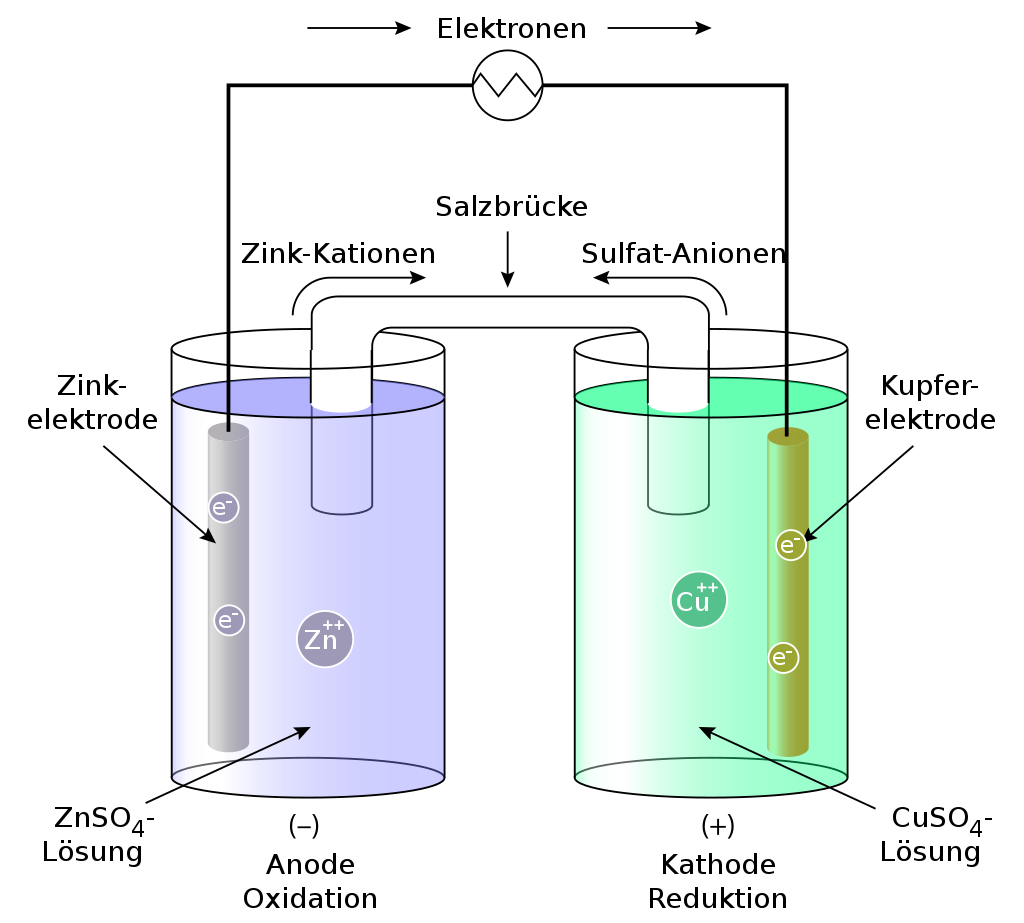
Abbildung 1: Schematische Darstellung einer Zink-Kupfer galvanischen Zelle. (©Rehua)
Welche Batterietypen gibt es? – Primär vs. Sekundär
Zuvor haben wir Batterien nach dem Aggregatzustand des Elektrolyten unterschieden (Nasszellen, Gelzellen, Trockenzellen). Batterien werden aber auch nach ihrer Wiederaufladbarkeit unterschieden. Im Allgemeinen unterscheidet man zwischen Primär- und Sekundärbatterien.
Primärbatterien
Primärbatterien sind dafür ausgelegt, bis zur Erschöpfung der Energie verwendet zu werden. Ihre chemischen Reaktionen sind in der Regel nicht umkehrbar, wodurch sie nicht wieder aufgeladen werden können. Sobald der Vorrat an Reaktanten in der Batterie erschöpft ist, erzeugt die Batterie keinen Strom mehr und ist unbrauchbar.
Sekundärbatterien
Sekundärbatterien können wieder aufgeladen werden, d. h. ihre chemischen Reaktionen können durch Anlegen eines elektrischen Stroms an die Zelle umgekehrt werden. Dadurch werden die ursprünglichen chemischen Reaktanten regeneriert, so dass sie wieder verwendet werden können, und zwar mehrere Male.
In der folgenden Tabelle werden einige grundlegende Aspekte von Primär- und Sekundärbatterien zusammengefasst und miteinander verglichen:
| Primärbatterien | Sekundärbatterien | |||
| Wiederaufladbarkeit | Nicht wiederaufladbar, für den einmaligen Gebrauch bestimmt. | Wiederaufladbar, kann mehrfach verwendet werden. | ||
| Energiedichte | Haben im Allgemeinen eine höhere Anfangsenergiedichte, was bedeutet, dass sie mehr Energie in einem bestimmten Volumen speichern können. | Etwas geringere Anfangsenergiedichte | ||
| Lebensdauer | Haben oft eine längere Lagerbeständigkeit als Sekundärbatterien, aber aufgrund der Nicht-Wiederaufladbarkeit ist die Nutzungsdauer viel kürzer. | Die Anzahl der Lade-/Entladezyklen hängt von der chemischen Zusammensetzung und der Anwendung ab, dennoch bei weitem längere Lebensdauer als bei Primärbatterien. | ||
| Anwendungen | Werden üblicherweise in Geräten verwendet, die für eine begrenzte Zeit eine konstante Stromversorgung benötigen und bei denen ein Wiederaufladen nicht möglich oder praktisch ist: Rauchmelder, Fernbedienungen, … | Bevorzugt für Geräte, die regelmäßig benutzt werden und deren Wiederaufladung von Vorteil ist: Smartphones, Laptops, Autos, … | ||
| Beispiele | Zink-Kohle, Alkali-Mangan, Lithium-Iod, Nickel-Oxyhydroxid, … | Blei-Säure, Lithium-Ionen, Nickel-Cadmium, Silberoxid-Zink, … |
Was sind die Hauptmerkmale einer Batterie? – Kenndaten und Eigenschaften
Zu den wesentlichen Kenndaten einer Batterie gehören im Allgemeinen die Batteriekapazität, die Entladegeschwindigkeit und die Gesamtleistung. Sie können je nach Last- und Ladezyklus sowie Lebensdauer aufgrund vieler Faktoren variieren. Die wichtigsten Faktoren sind die interne chemische Zusammensetzung, die Stromaufnahme und die Temperatur. Je nach Anwendung ist es unerlässlich, die Leistungsmerkmale einer Batterie zu überwachen bzw. regelmäßig zu überprüfen – egal ob für Elektrofahrzeuge in der Automobilindustrie, für Batteriespeicherkraftwerke in der Energiewirtschaft oder für andere Anwendungen.
Deshalb bieten wir Ihnen bei DEWETRON verschiedene Lösungen an, um die Leistungsmerkmale einer Batterie zu messen und zu analysieren, wie z.B.:
- Zellencharakterisierung bei verschiedenen Lastprofilen und verschiedenen Temperaturen,
- Langzeitperformance- und Alterungstests,
- Prüfung auf Modul- und Systemebene hinsichtlich des Zusammenwirkens des gesamten Batteriesystems und Batteriemanagements,
- Überprüfungen wie z.B. Überladen, Kurzschluss, mechanische Beschädigung, Überhitzung.
Erkunden Sie unsere Produktpalette, wählen Sie Ihr ideales Messsystem und starten Sie Ihre Analyse mit unserer intuitiven Messsoftware OXYGEN. Bei Interesse oder offenen Fragen können Sie uns hier direkt kontaktieren.